1. 心臟衰竭特性為不論是在運動中或休息時,心臟無法充份提供身體需要的充氧血。心臟衰竭是一種症候群,主要的症狀如:呼吸困難及液體滯留徵兆。一旦出現心臟衰竭,病患的生活品質與生命將受的威脅。依據美國心臟衰竭及歐洲心臟衰竭登錄性研究,一次急性心臟衰竭的病患,未來一年內需要再次住院或是發生死亡的機會超過三成。反覆的心臟衰竭進入慢性心臟衰竭後,病人可能合併更多的急性醫療病況及慢性醫療病況。許多心臟衰竭的病患合併不等程度的腎功能障礙。而出現心腎症候群的病患,癒後往往不好。
2. 為執行心臟衰竭優質臨床試驗進而提升心臟衰竭病患照護品質,我們建立心臟衰竭臨床試驗合作聯盟。
3. 運用臺北榮民總醫院過去的成績、臨床試驗的優勢,帶動臺灣心臟衰竭臨床試驗的發展,領導臺灣其他醫院共同加入國際心臟衰竭臨床試驗網路,並進一步能制定符合國人疾病現況的治療方針,達到個人化醫療的目的,提升國民健康。
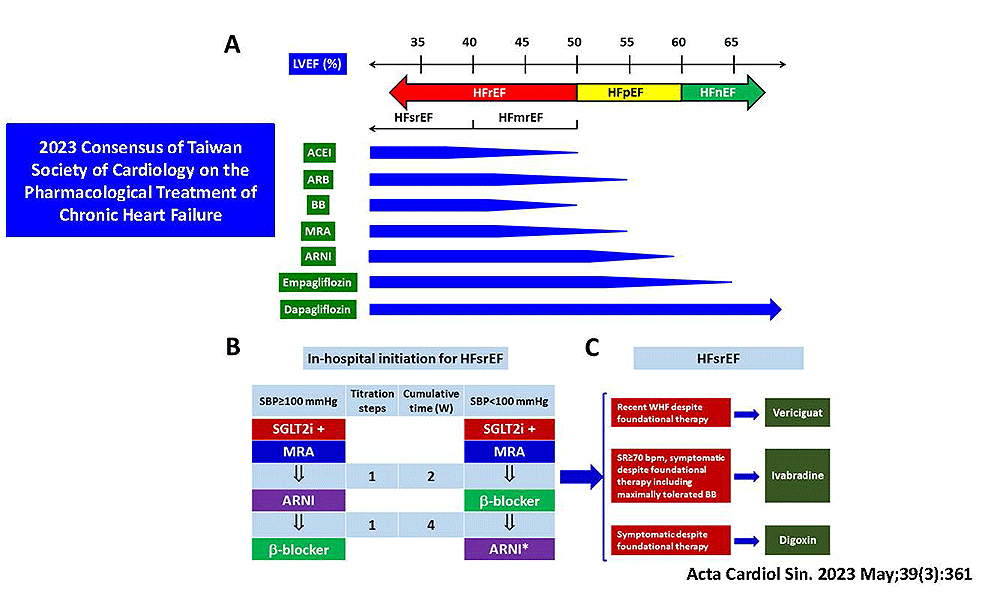
1. 射出分率降低之心臟衰竭
- BAY14564 [ARTS]
一項隨機分配、雙盲、雙重虛擬、多中心試驗,針對因慢性心臟衰竭惡化併發左心室收縮功能異常而至醫院緊急就醫,且患有第2型糖尿病(併含/不併含慢性腎臟病)或僅患有中度慢性腎臟病的受試者,評估BAY 94-8862相較於eplerenone的安全性及療效。
- BAY15371 [SOCRATES-REDUCED]
一項隨機、平行分組、安慰劑對照、雙盲、多中心、劑量探索第II 期試驗,針對表現出低收縮分率之心臟衰竭惡化(HFrEF)病患,研究口服水溶性鳥苷酸環化酶(sGC)刺激劑BAY 1021189 於12週期間四種劑量療程的藥效學作用、安全性與耐受性以及藥動學
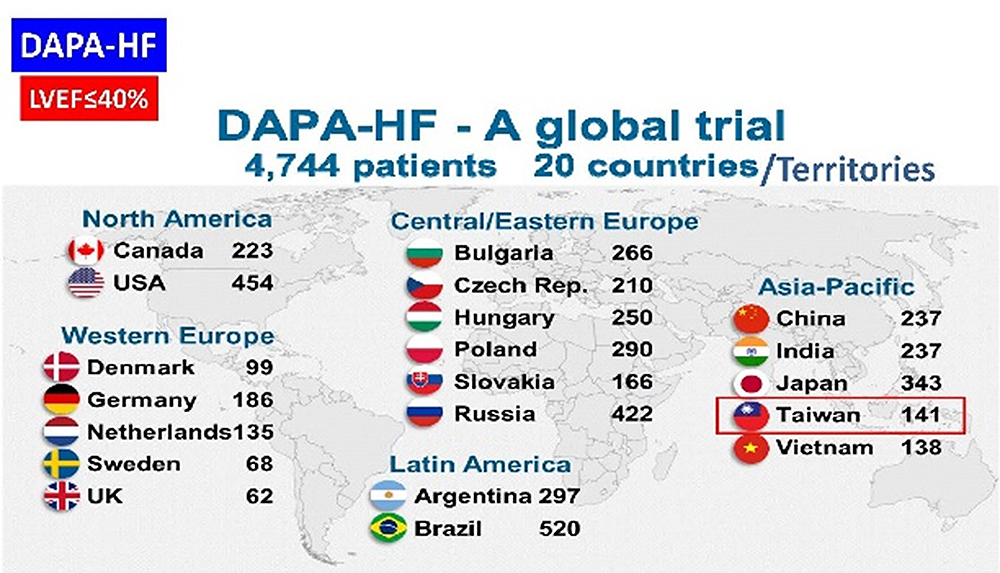
- D1699C00001 [DAPA-HF]
評估低收縮分率之慢性心衰竭病患使用Dapagliflozin在心衰竭惡化或心血管死亡發生率效果的試驗
- MK1242-001 [VICTORIA]
於低收縮分率心衰竭(HFrEF)受試者,評估口服可溶性鳥苷酸環化酶(sGC)刺激劑Vericiguat之療效與安全性的隨機分配、平行分組、安慰劑對照、雙盲、事件驅動、多中心、樞紐性第三期臨床結果試驗-於低收縮分率心衰竭受試者的VerICiguaT全球試驗
- MK1242-035 [VICTOR]
一項樞紐第三期隨機分組、安慰劑對照的臨床試驗,評估鳥苷酸環化酶(sGC)刺激劑Vericiguat/MK-1242用於治療射出低收縮分率之慢性心臟衰竭成人的療效與安全性
2. 射出分率正常之心臟衰竭
- BAY15829 [SOCRATES-PRESERVED]
一項隨機、平行分組、安慰劑對照、雙盲、多中心、劑量探索第II 期試驗,針對表現出正常收縮分率之心臟衰竭惡化(HFpEF)病患,研究口服水溶性鳥苷酸環化酶(sGC)刺激劑BAY 1021189 於12 週期間四種劑量療程的藥效學作用、安全性與耐受性以及藥動學
- I8F-MC-GPID [SUMMIT]
一項隨機分配、雙盲、安慰劑對照的第3期試驗,比較Tirzepatide與安慰劑在患有正常收縮分率心衰竭及肥胖症病患的療效和安全性
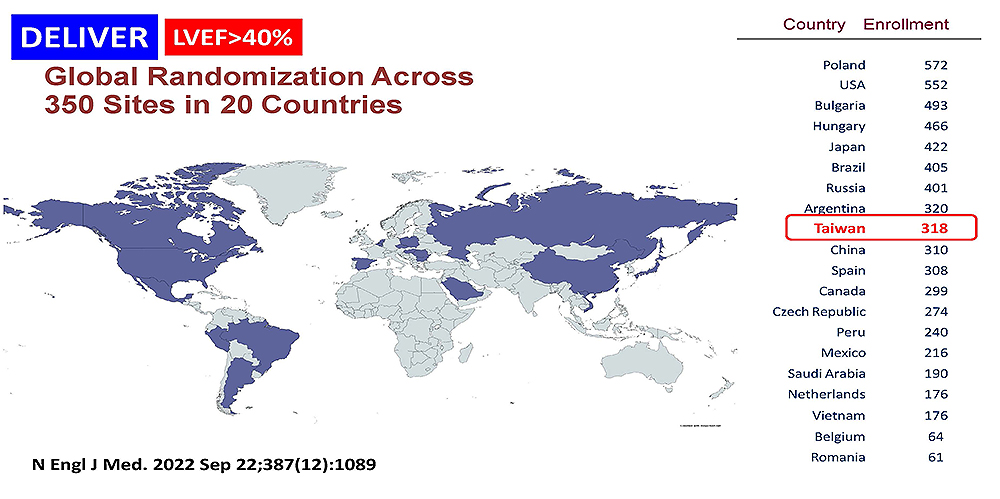
- D169CC00001 [DELIVER]
一項國際性、雙盲、隨機分配、安慰劑對照的第三期試驗,針對射出分率正常之心臟衰竭 (HFpEF) 患者,評估使用Dapagliflozin 在降低心血管死亡或心臟衰竭惡化的療效
- BAY20103 [FINEARTS-HF]
一項多中心、隨機分配、雙盲、平行分組、安慰劑對照試驗,評估finerenone用於患有心臟衰竭(NYHA II - IV)及左心室射出分率≥ 40% (LVEF ≥ 40%)參與者之發病率和死亡率上的療效與安全性
- D6580C00010 [ENDEAVOR]
一項隨機分配、雙盲、安慰劑對照、多中心第 2b 期和第 3 期的連續性試驗,針對左心室射出率 >40% 之心臟衰竭受試者,評估使用 AZD4831 最長 48 週的療效和安全性
3. 複雜型心臟衰竭
- D6402C00001 [MIRACLE]
一項第2b期、隨機分配、雙盲、活性對照、多中心試驗,針對有慢性腎病的心臟衰竭病患給予口服AZD9977及Dapagliflozin治療,以評估其療效、安全性及耐受性
- EX6018-4915 [HERMES]
Ziltivekimab 相較於安慰劑,對於患有輕度低收縮分率心衰竭或射出分率正常心衰竭以及全身性發炎的患者罹病率及死亡率之影響。
國際合作面向
1. 臺灣心臟衰竭臨床試驗合作聯盟主持人擔任下面所列的所有臨床試驗之臺灣總主持人爭取國內外藥廠臨床試驗,並透過臺灣心臟衰竭臨床試驗合作聯盟加速收案
- 1. 計畫編號:D1699C00001 [DAPA-HF]
- 試驗期別:III
參與國家:臺灣、中國、印度、日本、越南、保加利亞、捷克、丹麥、德國、匈牙利、荷蘭、波蘭、俄羅斯、斯洛伐克、瑞典、英國、阿根廷、巴西、加拿大、美國
- 2. 計畫編號:D169CC00001 [DELIVER]
- 試驗期別:III
參與國家:臺灣、中國、日本、沙烏地阿拉伯、越南、保加利亞、捷克、法國、匈牙利、荷蘭、比利時、波蘭、羅馬尼亞、俄羅斯、西班牙、阿根廷、巴西、墨西哥、秘魯、加拿大、美國
- 3. 計畫編號:MK1242-001 [VICTORIA]
- 試驗期別:III
參與國家:臺灣、奧地利、比利時、捷克共和國、丹麥、芬蘭、法國、德國、匈牙利、意大利、荷蘭、挪威、波蘭、西班牙、瑞典、瑞士、英國/愛爾蘭、以色列、俄國、南非、土耳其、烏克蘭、阿根廷、巴西、智利、哥倫比亞、墨西哥、波多黎各、澳大利亞/紐西蘭、中國、日本、韓國、馬來西亞、菲律賓、新加坡、香港、加拿大、美國
- 4. 計畫編號:D6402C00001 [MIRACLE]
- 試驗期別:II
參與國家:臺灣、立陶宛、波蘭、俄羅斯、斯洛伐克、西班牙、瑞典、烏克蘭、日本、加拿大、美國、韓國、泰國、比利時、保加利亞、捷克共和國、丹麥、德國、匈牙利、義大利
- 5. 計畫編號:BAY20103 [FINEARTS-HF]
- 試驗期別:III
參與國家:臺灣、阿根廷、澳大利亞、奧地利、英國、荷蘭、紐西蘭、波蘭、葡萄牙、斯洛伐克、南非、西班牙、烏克蘭、美國、墨西哥、比利時、巴西、保加利亞、加拿大、中國、哥倫比亞、捷克、丹麥、愛沙尼亞、芬蘭、法國、德國、希臘、香港、匈牙利、印度、以色列、義大利、日本、南韓、拉脫維亞、立陶宛、馬來西亞、瑞典、挪威、土耳其、羅馬尼亞、俄羅斯、新加坡
- 6. 計畫編號:I8F-MC-GPID [SUMMIT]
- 試驗期別:III
參與國家:臺灣、阿根廷、巴西、中國、印度、以色列、墨西哥、俄國、美國
- 7. 計畫編號:D6580C00010 [ENDEAVOR]
- 試驗期別:IIb/III
參與國家:臺灣(亞洲唯一參加國家)、阿根廷、巴西、保加利亞、加拿大、捷克、丹麥、法國、匈牙利、日本、波蘭、俄羅斯、斯洛伐克、瑞典、美國
- 8. 計畫編號:MK1242-035 [VICTOR]
- 試驗期別:III
參與國家:臺灣、加拿大、美國、巴西、智利、哥倫比亞、墨西哥、秘魯、義大利、波蘭、俄羅斯、南非、西班牙、瑞典、土耳其、波多黎各、奧地利、捷克、丹麥、法國、德國、希臘、匈牙利、以色列、英國、烏克蘭、澳洲、中國、香港、馬來西亞、紐西蘭、新加坡、南韓
- 9. 計畫編號:EX6018-4915 [HERMES]
- 試驗期別:III
參與國家:臺灣、羅馬尼亞、立陶宛、北馬其頓共和國、馬來西亞、墨西哥、紐西蘭、挪威、波蘭、葡萄牙、塞爾維亞、新加坡、斯洛伐克、斯洛維尼亞、南非、南韓、西班牙、泰國、土耳其、英國、美國、阿根廷、澳洲、奧地利、比利時、波士尼亞、巴西、保加利亞、加拿大、中國、哥倫比亞、克羅埃西亞、捷克、丹麥、愛沙尼亞、芬蘭、法國、德國、希臘、匈牙利、印度、愛爾蘭、以色列、義大利、日本、拉脫維亞
2. 臺灣心臟衰竭臨床試驗合作聯盟主持人擔任 Steering Committee Member或學術專家顧問代表臺灣參與國際會議,讓臺灣心臟衰竭臨床試驗合作聯盟亮眼表現能名揚國際
- 1. 計畫編號:D1699C00001 [DAPA-HF]
- 試驗期別:III
參與國家:臺灣、中國、印度、日本、越南、保加利亞、捷克、丹麥、德國、匈牙利、荷蘭、波蘭、俄羅斯、斯洛伐克、瑞典、英國、阿根廷、巴西、加拿大、美國
- 2. 計畫編號:D169CC00001 [DELIVER]
- 試驗期別:III
參與國家:臺灣、中國、日本、沙烏地阿拉伯、越南、保加利亞、捷克、法國、匈牙利、荷蘭、比利時、波蘭、羅馬尼亞、俄羅斯、西班牙、阿根廷、巴西、墨西哥、秘魯、加拿大、美國
- 3. 計畫編號:MK1242-001 [VICTORIA]
- 試驗期別:III
參與國家:臺灣、奧地利、比利時、捷克共和國、丹麥、芬蘭、法國、德國、匈牙利、意大利、荷蘭、挪威、波蘭、西班牙、瑞典、瑞士、英國/愛爾蘭、以色列、俄國、南非、土耳其、烏克蘭、阿根廷、巴西、智利、哥倫比亞、墨西哥、波多黎各、澳大利亞/紐西蘭、中國、日本、韓國、馬來西亞、菲律賓、新加坡、香港、加拿大、美國
- 4. 計畫編號:EX6018-4915 [HERMES]
- 試驗期別:III
參與國家:臺灣、羅馬尼亞、立陶宛、北馬其頓共和國、馬來西亞、墨西哥、紐西蘭、挪威、波蘭、葡萄牙、塞爾維亞、新加坡、斯洛伐克、斯洛維尼亞、南非、南韓、西班牙、泰國、土耳其、英國、美國、阿根廷、澳洲、奧地利、比利時、波士尼亞、巴西、保加利亞、加拿大、中國、哥倫比亞、克羅埃西亞、捷克、丹麥、愛沙尼亞、芬蘭、法國、德國、希臘、匈牙利、印度、愛爾蘭、以色列、義大利、日本、拉脫維亞

二、經濟效益
- 協助英國大藥廠,評估低收縮分率之慢性心衰竭病患使用Dapagliflozin在心衰竭惡化或心血管死亡發生率效果的試驗臨床試驗。(臨床試驗Phase III)
亮點成果: 臺灣心臟衰竭臨床試驗合作聯盟納入首位亞洲區受試者,並且臺灣收案超出預期得到肯定,2020年5月美國食品藥物管理局及2021年8月臺灣食品藥物管理署給予dapagliflozin治療低收縮分率心臟衰竭的新適應症。
- 協助美國 公司,一項樞紐第三期隨機分組、安慰劑對照的臨床試驗,評估鳥苷酸環化酶(sGC)刺激劑Vericiguat/MK-1242用於治療射出低收縮分率之慢性心臟衰竭成人的療效與安全性。(臨床試驗Phase III)
亮點成果: 試驗藥物vericiguat於2021年1月20日通過美國食品藥物管理署審查用於治療心臟衰竭病患,臺灣食品藥物管理署也於2021年7月05日核准此適應症。
- 協助英國 大藥廠,一項國際性、雙盲、隨機分配、安慰劑對照的第三期試驗,針對射出分率正常之心臟衰竭 (HFpEF) 患者,評估使用Dapagliflozin 在降低心血管死亡或心臟衰竭惡化的療效。(臨床試驗Phase III)
亮點成果: 臺灣納入318名病患加入試驗,本試驗在臺灣花費約3億台幣,並於歐洲心臟學會年會112年08月會議中進行多項學術發表,結果顯示Dapagliflozin在射出分率正常之心臟衰竭患者能有效減少心臟衰竭惡化及死亡,Dapagliflozin 美國食品藥物管理署於112年05月核准新適應症:用於成人心臟衰竭患者以降低心血管原因死亡、心衰竭住院和心臟衰竭急診的風險,臺灣食品藥物管理署也於112年08月核准此新適應症。
三、社會影響
- 臺灣心臟衰竭臨床試驗合作聯盟合作執行大型心臟衰竭新藥試驗DAPA-HF,臨床試驗結果顯示dapagliflozin能有效減少嚴重心臟衰竭病患死亡率達17%、減少病患心臟衰竭惡化達30%,藥品獲得新適應症。
- 臺灣心臟衰竭臨床試驗合作聯盟合作執行VICTORIA臨床試驗,結果顯示vericiguat能有效減少心臟衰竭病患死亡率或再住院達10%,新藥品成功上市。
- 臺灣心臟衰竭臨床試驗合作聯盟合作執行DELIVER試驗,結果顯示dapagliflozin能使心臟衰竭病患下降10%死亡率及29%再住院率,歐洲心臟醫學會於2023年08月推出最新心臟衰竭治療指引修正,認同此一決定。
四、聯盟重要記事